Opracowanie:
Arsen (As)
Arsen (As)
Arsen (As)
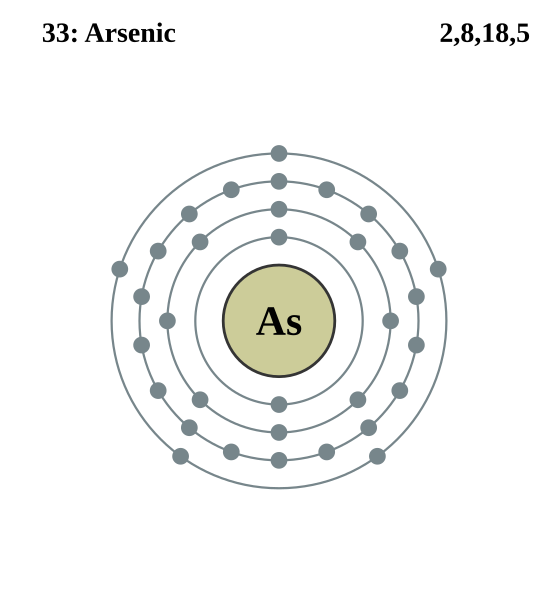
Arsen (łac. arsenicum) jest pierwiastkiem chemicznym o symbolu As, znajduje się w grupie 15. (azotowców), 4. okresie i ma właściwości półmetalu (metaloidu). W temperaturze pokojowej występuje w stałym stanie skupienia. Jego masa atomowa wynosi 74,921595(6) u, a liczba atomowa jest równa 33. Jego temperatura topnienia to 814 °C, natomiast temperatura wrzenia wynosi 614 °C (pierwiastek sublimuje w tej temperaturze). Konfiguracja elektronowa [Ar] 3d104s24p3. Zapełnienie powłok arsenu prezentuje się w ten sposób K2L8M18N5
wizualizacja powłok elektronowych atomu arsenu
Arsen występuje w ilości 2,5 ppm w skorupie ziemskiej. Tworzy on ponad dwieście minerałów, najbardziej znane to: aurypigment, arsenopiryt, realgar, lelingit. Pierwiastek w naturze występuje w bardzo dużej liczbie związków arsenoorganicznych, na przykład: organiczne pochodne arsyny oraz kwas kakodylowy. Jednym z naturalnych źródeł arsenu są erupcje wulkaniczne (produkują około 17000 ton rocznie). Innym źródłem półmetalu jest ługowanie go ze skał magmowych i osadowych. Arsen jest emitowany także w wyniku spalania paliw kopalnianych oraz procesów wydobycia i hutnictwa rud metali nieżelaznych. Wydobycie łączne arsenu na świecie wynosi około 35000 ton rocznie (w przeliczeniu na tlenek arsenu(III) (As2O3)), jedynie 3% z podanej masy stanowi czysty metal. Liderami światowej produkcji pierwiastka są Chiny i Chile. Uzyskuje się go głównie na dwa sposoby: przez redukcję arszeniku węglem lub tlenkiem węgla, poprzez rozkład lelingitu albo arsenopirytu w temperaturze wynoszącej 650-700 °C.
Istnieją dwie odmiany alotropowe arsenu:
α — kruchy metal, który matowieje po kontakcie z powietrzem oraz silnie reaguje z wodą;
β — bezpostaciowy, żółty proszek, jest dużo mniej reaktywny od pierwszej odmiany.
Prawdopodobnie po raz pierwszy arsen został wyodrębniony w 1250 roku przez alchemika Alberta Wielkiego. W czasach starożytnych substancje, które zawierały realgar oraz aurypigment były stosowane do leczenia chorób płuc i skóry. W wieku XVIII i XIX preparaty arsenowe były stosowane do zwalczania bardzo wielu chorób, na przykład: białaczki, astmy, gruźlicy, malarii, nadciśnienia. Jednak w drugiej połowie XX wieku wycofano z obiegu leki zawierające arsen (mimo dużej skuteczności), ponieważ miały właściwości rakotwórcze. Poza medycyną arsen stosuje się między innymi w: produkcji półprzewodników i bojowych środków trujących, polepszania jakości niektórych stopów, impregnowaniu drewna.
Arsen jest jednym z mikroelementów, jednak jego nadmiar powoduje bardzo silne zatrucia. Wszystkie związki arsenu w różnym stopniu mają właściwości protoplazmatyczne (niszczą u bakterii ściany komórkowe) oraz rakotwórcze. Arsen w komórkach także zakłóca procesy enzymatyczne. Toksyczność związków arsenu jest zależna od formy, w jakiej są przyjmowane. Ostre zatrucia arsenem charakteryzuje się podrażnieniem żołądkowo-jelitowym, obniżeniem ciśnienia krwi, krwiomoczem, zaburzeniami ze strony układu nerwowego oraz żółtaczką. Objawy przewlekłego zatrucia pojawiają się najczęściej po kilku latach. Mogą być to nowotwory płuc, skóry, nerek, wątroby oraz pęcherza moczowego. Jednak bardzo często takie zatrucia kończą się zwykłymi zmianami skórnymi (przebarwieniami, rogowaceniem, zapaleniami skórnymi). Natomiast w przypadku zatrucia pokarmowego pojawiają się najczęściej stany zapalne i podrażnienia układu pokarmowego. Dłuższe przyjmowanie małych dawek związków arsenu skutkuje wzrostem odporności na ostre zatrucia takimi substancjami. Bardzo mały odsetek ludzi posiada wrodzoną odporność na pochodne arsenu.
Zatrucie arszenikiem (As2O3) jest jedną z najczęstszych przyczyn zatruć związkami arszeniku. Jego dawka śmiertelna wynosi około 10-50 mg, a dawka śmiertelna przy ostrym zatruciu to 70-200 mg lub 1mg/kg m.c./dzień. Dawniej arszenik stosowano do aborcji, co bardzo często skutkowało śmiertelnym zatruciem kobiety. Na przełomie XIX i XX wieku popularny był płyn Fowlera, czyli roztwór arszeniku i wodorowęglanu potasu. Używano go do leczenia między innymi chorób skóry, gdy środek został przedawkowany, powodował zatrucia przewlekłe. W medycynie współczesnej arszenik wykorzystuje się do leczenia nowotworów oraz ostrej białaczki promielocytowej.
Izotopy arsenu:
60As — Z = 33, n = 27;
61As — Z = 33, n = 28;
62As — Z = 33, n = 29;
63As — Z = 33, n = 30, okres półtrwania wynosi <43 ns;
64As — Z = 33, n = 31, okres półtrwania to 36(25) ms;
65As — Z = 33, n = 32, okres półtrwania wynosi 128(16) ms;
66As — Z = 33, n = 33, okres półtrwania to 95,77(23) ms;
67As — Z = 33, n = 34, okres półtrwania wynosi 128(16) ms;
68As — Z = 33, n = 35, okres półtrwania to 151,6(8) s;
69As — Z = 33, n = 36, okres półtrwania wynosi 15,2(2) min;
70As — Z = 33, n = 37, okres półtrwania to 52,6(3) min;
71As — Z = 33, n = 38, okres półtrwania wynosi 65,30(7) h;
72As — Z = 33, n = 39, okres półtrwania to 26,0(1) h;
73As — Z = 33, n = 40, okres półtrwania wynosi 80,30(6) d;
74As — Z = 33, n = 41, okres półtrwania to 17,77(2) d;
75As — Z = 33, n = 42, jest stabilny;
76As — Z = 33, n = 43, okres półtrwania to 1,094 2(7) d;
77As — Z = 33, n = 44, okres półtrwania wynosi 38,83(5) h;
78As — Z = 33, n = 45, okres półtrwania to 90,7(2) min;
79As — Z = 33, n = 46, okres półtrwania wynosi 9,01(15) min;
80As — Z = 33, n = 47, okres półtrwania to 15,2(2) s;
81As — Z = 33, n = 48, okres półtrwania wynosi 33,3(8) s;
82As — Z = 33, n = 49, okres półtrwania to 19,1(5) s;
83As — Z = 33, n = 50, okres półtrwania wynosi 13,4(4) s;
84As — Z = 33, n = 51, okres półtrwania to 4,02(3) s;
85As — Z = 33, n = 52, okres półtrwania wynosi 2,021(12) s;
86As — Z = 33, n = 53, okres półtrwania to 0.945(8) s;
87As — Z = 33, n = 54, okres półtrwania wynosi 484(40) ms;
88As — Z = 33, n = 55, okres półtrwania to 200 ms;
89As — Z = 33, n = 56, okres półtrwania wynosi >300 ns;
90As — Z = 33, n = 57, okres półtrwania to >300 ms;
91As — Z = 33, n = 58, okres półtrwania wynosi >150 ns;
92As — Z = 33, n = 59, okres półtrwania to >300 ms.