Opracowanie:
Liczba masowa i atomowa
Liczba masowa i atomowa
Liczba atomowa i masowa to dwa pojęcia, które powinniśmy rozróżniać, aby zagłębić się bardziej w świat chemii. Z tymi pojęciami najczęściej będziemy spotykać się używając układu okresowego pierwiastków chemicznych. Spójrz na poniższy rysunek.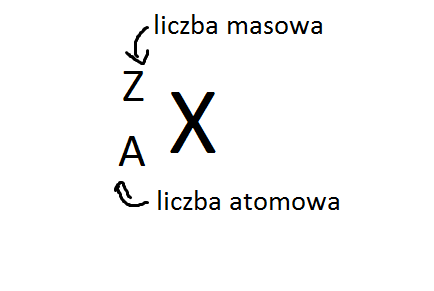
X jest dowolnym pierwiastkiem chemicznym, A to liczba atomowa, Z to liczba masowa.
LICZBA MASOWA (Z) mówi nam o tym, ile wynosi suma protonów i neutronów (protony i neutrony znajdują się w jądrze atomowym).
LICZBA ATOMOWA (A) mówi nam o tym, jaką jest liczba protonów w jądrze. Liczba elektronów jest równa liczbie protonów, ponieważ ładunki muszą się równoważyć.
Chcąc więc szybko podać liczbę protonów, elektronów i neutronów wystarczy sprawnie korzystać z układu okresowego pierwiastków chemicznych.
Aby podać liczbę elektronów –> odczytujesz liczbę atomową
Aby podać liczbę protonów –> odczytujesz liczbę atomową
Aby podać liczbę neutronów –> odczytujesz liczbę masową i odejmujesz od niej liczbę atomową
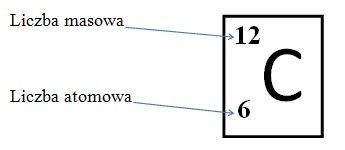
Korzystając z układu okresowego, należy wiedzieć, gdzie szukać liczby atomowej i masowej. Pamiętaj, że każdy układ może się troszkę różnić wyglądem, dlatego zanim z niego skorzystasz spójrz na rozpisany pierwiastek na górze układu. Zazwyczaj jeden pierwiastek jest dokładnie opisany. W naszym przypadku jest to węgiel.
Czas na przykłady!!
Węgiel ma liczbę atomową równą 6, a liczbę masową równą 12. Oznacza to, że liczba jego protonów to 6, elektronów również 6, a neutronów: 12-6=6
Chlor ma liczbę atomową równą 17, a liczbę masową równą 35. Oznacza to, że liczba jego protonów to 17, elektronów również 17, a neutronów: 35-17=18
Sprawdź swoją wiedzę: Odczytaj liczbę atomową i masową oraz podaj ile protonów, neutronów i elektronów ma tlen oraz sód.