Opracowanie:
Układ okresowy pierwiastków
Układ okresowy pierwiastków
Układ okresowy pierwiastków (potocznie tablica Mendelejewa) to rzecz, z której na całym świecie korzystają osoby takie jak naukowcy, chemicy, czy zwykli uczniowie oraz studenci. Spotkamy go w wielu różnych miejscach takich jak szkoły czy uczelnie i laboratoria. Chciałabym przybliżyć wam jego powstanie, funkcjonowanie i co wpłynęło na to, jak on wygląda teraz.
Informacje ogólne
Układ okresowy to tabela, która pokazuje nam zestawienie wszystkich znanych nam pierwiastków chemicznych, które jest uporządkowane według rosnącej ich liczby atomowej (Z). Określa ona nic innego, jak liczbę protonów w jądrze atomowym pierwiastka chemicznego oraz jest równa ładunkowi elementarnemu. Gdybyśmy chcieli zapisać ją symbolicznie to znajdowała by się ona na dole, a wyglądałoby to tak:
Grupy – pionowe kolumny układu okresowego. W obecnym, standardowym układzie znajdziemy ich 18. Pierwiastki wchodzące w skład poszczególnej grupy posiadają podobne właściwości. Podzielone są one na grupy główne (1,2 oraz 13-18) oraz poboczne (3-12). Oprócz numerów grup możemy stosować także nazewnictwo słowne, które określa poszczególne rodziny pierwiastków. Tworzymy je poprzez dodanie do nazwy pierwszego pierwiastka grupy końcówki „-owce” np. Berylowce, Fluorowce, Helowce. Jednak tak jak w prawie każdej regule znajdziemy wyjątek – stanowi go grupa 1, która nazywa się Litowce zamiast Wodorowce. Zmiana ta wynikła z odmiennych właściwości wodoru w porównaniu z właściwościami pozostałych pierwiastków grupy.
Okresy – poziome rzędy układu okresowego. W obecnym, standardowym układzie możemy znaleźć ich 7. Każdy następny pierwiastek rzędu ma o jeden proton więcej oraz mniejszą metaliczność od poprzednika. Pierwiastki ułożone w tym samym okresie mają taką samą liczbę orbitali atomowych (powłok, na których znajdują się elektrony krążące wokół jądra atomowego danego pierwiastka). Każdy okres ma także swój odpowiednik literowy (tzw. powłoki):
okres 1 – K (na tej powłoce mogą znaleźć się maksymalnie 2 elektrony)
okres 2 – L (na tej powłoce znajdziemy maksymalnie 8 elektronów)
okres 3 – M (na niej znajdziemy maksymalnie 18 elektronów)
okres 4 – N (ta powłoka zawiera maksymalnie 32 elektrony)
okres 5 – O (na tej powłoce atom może zawierać maksymalnie 50 elektronów)
okres 6 – P (atom posiadający tą powłokę ma maksymalną liczbę elektronów równą 72)
okres 7 – Q (na tej powłoce u atomu znajdziemy maksymalnie 98 elektronów)
Bloki – ostatni rodzaj podziału układu okresowego. Wygląda on następująco: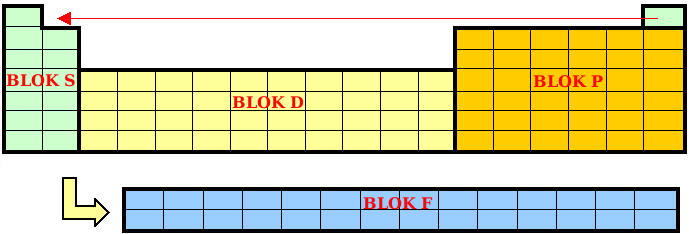
Krótka historia układu okresowego
Niektóre znane nam w tym momencie pierwiastki były odkryte już w starożytności, jednak wtedy nie nosiły jeszcze tego miana – pierwiastkami były podstawowe żywioły czyli woda, ziemia, ogień i powietrze. Przemiany materii (czyli po prostu reakcje chemiczne) pojmowano wtedy jako efekt zmiany ilości wyżej wymienionych żywiołów. W ten oto sposób narodziła się alchemia, której niektóre podstawowe techniki współcześni chemicy wykorzystują do dziś. Chociaż większość z nich okazała się fałszywa to właśnie starożytni oraz średniowieczni alchemicy z całego świata stworzyli podstawy wiedzy o substancjach chemicznych oraz reakcjach zachodzących pomiędzy nimi.
Koncepcję pierwiastka uważnie badał Antoine Lavoisier. Zaproponował on bardzo prostą definicję pierwiastka jako substancji, która nie może być rozłożona na prostsze elementy. Jego pogląd i definicja wyniknęła z tego, iż starannie ważył on reagenty oraz produkty, które biorą udział w różnych procesach chemicznych. Dzięki temu wykazał on, że podczas reakcji nie dochodzi do utraty masy. Oprócz tego wyjaśnił również proces spalania jako połączenie się substancji z tlenem. Ukazał to na podstawie wodoru, który spalając się łączy się z tlenem i tworzy razem z nim wodę, a nawet udało mu się ten proces odwrócić – rozłożyć wodę na dwa różne pierwiastki. Poniżej lista, którą uczony stworzył – jest to jedna z pierwszych klasyfikacji pierwiastków znanych w tym czasie. Jednak znalazło się wśród nich między innymi światło, ciepło czy kreda, które jak dzisiaj wiadomo pierwiastkami nie są.
Jednak pierwowzór tablicy używanej dzisiaj stworzył wybitny rosyjski chemik – Dimitrij Iwanowicz Mendelejew. Ułożył on pierwszy układ, który składał się z pierwiastków ustawionych w miarę rosnącej masy atomowej, a oprócz tego uporządkował je także w grupy, jednak te ułożone są poziomo. Dodatkowo poza znanymi wtedy pierwiastkami możemy zauważyć znaki zapytania, które są miejscem przygotowanym dla nieznanych jeszcze wtedy pierwiastków, co pozwoliło mu na przewidzenie ciężaru atomowego oraz właściwości pierwiastka, co ułatwiło w przyszłości ich poszukiwania, a w ciągu paru następnych lat jego tablicę uzupełniono w kilku miejscach. W ten właśnie sposób przewidział istnienie 8 dodatkowych pierwiastków, a 3 z nich (german, gal oraz skand) zostały odkryte jeszcze za jego życia. Mendelejew podczas tworzenia swojej tablicy nie miał wiedzy na temat kwantowej budowy materii, a w szczególności nie istniał tak ważny przy budowie układu okresowego – zakaz Pauliego. Początkowo jego dzieło zyskało negatywną sławę, gdyż nie znano żadnego racjonalnego wytłumaczenia na prawo okresowości. Sytuacja ta doprowadziła do tego, że sam autor zwątpił w swoje dzieło. Poniżej przedstawię wam porównanie pierwszego oraz dzisiaj używanego układu:
Układ okresowy, a właściwości chemiczne pierwiastków
Na współczesnym układzie okresowym możemy bardzo dobrze zauważyć zależności pomiędzy właściwościami chemicznymi danego pierwiastka, a jego położeniem w układzie. Pierwsze dwie grupy (wyłączając wodór) oraz grupy poboczne, to pierwiastki o bardzo silnych właściwościach metalicznych, czyli są one metalami. Metale charakteryzują się między innymi:
Tworzeniem gładkiej i połyskującej powierzchni, w momencie istnienia w stanie stałym
Są ciągliwe oraz kowalne
Bardzo dobrze przewodzą ciepło oraz prąd
Najczęściej tworzą one związki o właściwościach zasadowych oraz nukleofilowych
W temperaturze pokojowej występują w postaci ciała stałego (wyjątek to rtęć, która jest cieczą)
Posiadają wysoką temperaturę topnienia (ponownie rtęć jest wyjątkiem, gdyż jej temperatura topnienia to -39oC)
Są one bezwonne
Większość metali wykazuje właśnie te właściwości chemiczne, jednak pomimo tego możemy podzielić je na jeszcze mniejsze grupy, czyli:
Metale ziem alkaicznych – inaczej berylowce, czyli pierwiastki znajdujące się w drugiej grupie układu okresowego. W przyrodzie najczęściej występuje Wapń (Ca). Znajdziemy go w różnych postaciach jednak te najczęściej występują w skałach: węglan wapnia (CaCo3), siarczan wapnia (CaSO4), węglan magnezowo-wapniowy (CaMg(CO3)2) oraz fluorek wapnia (CaF2). Wszystkie metale ziem alkaicznych to metale miękkie, lekkie i łatwo topliwe. Właściwości te rosną wraz z kolejnymi okresami w grupie. Wszystkie te metale, za wyjątkiem berylu, cechują silne właściwości zasadowe (beryl – amfoteryczne). Wszystkie bardzo łatwo reagują z kwasami, tworząc sole oraz wodór w postaci lotnej.
Metale alkaiczne – jest to inna nazwa dla litowców, czyli pierwiastków z pierwszej grupy układu okresowego (za wyjątkiem wodoru). Wszystkie litowce można kroić nożem, a wynika to z ich małej twardości. Każdy litowiec to ciało stałe o srebrzystej barwie. Są bardzo reaktywne, co sprawia, że muszą być przechowywane w oleju lub atmosferze gazu obojętnego. Najbardziej reaktywnym z nich jest Cez, który może się samoistnie zapalić przy kontakcie z powietrzem. Lit, sód i potas mają gęstość mniejszą od wody, a im niżej położone są, tym wyższą mają gęstość i reaktywność, jednak maleje ich twardość i temperatura wrzenia oraz topnienia. Gdy spotkają one powietrze szybko pokrywają się warstwą tlenków oraz wodorotlenków
Metale przejściowe – są to metale bloku d, czyli grupy 3-12. Metale te wykazują cechy zarówno metali alkaicznych, jak i metali znajdujących się w bloku p. Mogą być bardzo reaktywne (itr, cyrkon) jak i nie reagować prawie w ogóle nawet z najsilniejszymi kwasami i zasadami (metale szlachetne – złoto, platyna). Prawie wszystkie pierwiastki z bloku d mają jedną wspólną cechę – posiadają zdolność tworzenia złożonych związków kompleksowych. Duża ich część wykazuje bardzo intensywne zabarwienie
Metale ziem rzadkich – w jej skład wchodzi 17 pierwiastków – wszystkie lantanowce oraz skand i itr, które należą do skandowców. Współwystępują w minerałach i mają one podobne właściwości chemiczne. Znajdują się one głównie w skorupie ziemskiej i zazwyczaj spotkamy je w formie węglanów, fosforanów, tlenków i krzemianów
Trzy przedostatnie grupy (15-17) zawierają pierwiastki, które mają silne właściwości niemetaliczne. Niemetale jak sama nazwa wskazuje nie wykazują właściwości metalicznych, a jednocześnie nie da się określić ich jednoznacznych cech wspólnych. Obecnie takich pierwiastków jest znacznie mniej niż metali – tylko 18. Zaliczają się do nich pierwiastki takie jak: wodór, węgiel, azot, fosfor, tlen, siarka, selen oraz 5 pierwiastków z grupy 17 i wszystkie gazy szlachetne. Ich ogólne wspólne cechy to:
Brak przewodzenia energii elektrycznej i ciepła, co czyni je izolatorami
Bardzo wysoka elektroujemność
Tlenki utworzone z tych pierwiastków mają charakter kwasowy (reguła ta nie dotyczy jednak gazów szlachetnych)
Zwykle posiadają niższe temperatury topnienia i wrzenia, niż metale o zbliżonych do nich masach atomowych
W temperaturze pokojowej są zazwyczaj gazami (wyjątek stanowi brom, który jest cieczą)
Pierwiastki grupy 18, to gazy szlachetne (inaczej helowce). Ich określenie wywodzi się z tego, iż pierwiastki zawarte w tej grupie osiągnęły oktet lub dublet (w wypadku Helu) – nie reagują z innymi pierwiastkami, gdyż nie muszą dążyć do zapełnienia swoich orbitali atomowych. Tak samo jak zawsze znajdziemy wyjątek od reguły – jest nim przykładowo argon, który w powłoce M posiada zapełnione podpowłoki „s” i „p”, a nie posiada zapełnionej w pełni podpowłoki „d”. Wszystkie helowce są bezwonne oraz bezbarwne. Posiadają niskie temperatury topnienia i są słabo rozpuszczalne w wodzie.
Ułożenie pierwiastków w odpowiedniej kolejności w grupie powoduje stopniowy wzrost metaliczności pierwiastków – im pierwiastek ma większą liczbę atomową tym bardziej jest on metaliczny. W pierwiastkach grup 13-17 zasada ta powoduje spadek niemetaliczności pierwiastków. Stąd bardzo łatwo możemy wywnioskować, że najbardziej metaliczny jest frans – pierwiastek znajdujący się na samym końcu 1 grupy, a najbardziej niemetaliczny jest fluor – pierwiastek znajdujący się na samym początku 17 grupy. Poniższe zdjęcie ukazuje wszystkie te zależności:
Podsumowując – układ okresowy od zawsze był, jest i będzie ważną częścią chemicznego świata. Pomimo zmieniających się jego wersji na przestrzeni wielu lat od zawsze, w prostej formie ukazywał nam zależności chemiczne pomiędzy poszczególnymi pierwiastkami, a także pośrednio pomiędzy ich prostymi związkami chemicznymi.




